Fungos Foliícolas em Syagrus coronata (Mart.) Becc. (Arecaceae): novos registros para o Brasil
Thaísa Danielly Costa Batista¹*, Vitória Maria Figueredo Souza ³, Nadja Santos Vitória²
¹Mestre em Biologia Vegetal, Universidade Federal de Uberlândia, Campus Umuarama, Instituto de Biologia.
2Graduanda em Ciências Biológicas pela Universidade do Estado da Bahia. Campus VIII, Departamento de Educação
3Professora da Universidade do Estado da Bahia, Programa de Pós-Graduação em Biodiversidade Vegetal (PPGVeg/UNEB), Campus VIII, Departamento de Educação.
*Autora para correspondência e-mail: thaisa.batista@ufu.br
Recebido: 04/07/2023 Aceito: 04/09/2024
Resumo: Foi investigada a micota foliar de Syagrus coronata (Mart.) Becc. no Sítio Brejinho da Serra, Pernambuco. Palmeiras utilizadas na confecção de produtos artesanais pela comunidade local, com o intuito de contribuir na ampliação do conhecimento sobre fungos em Arecaceae no bioma Caatinga. As coletas das folhas de S. coronata foram realizadas em três excursões entre novembro/2014 e julho/2015. No Laboratório de Ciências da Universidade do Estado da Bahia, Campus VIII-Paulo Afonso, o material coletado foi analisado, caracterizado morfologicamente e identificado. Nove gêneros e dez espécies de fungos, distribuídos em oito famílias foram estudados. Dos microfungos estudados, foram encontrados fitopatógenos e sapróbios, e novos registros de ocorrência para o Brasil e para o substrato botânico analisado. Foram catalogados: Chaetomium globosum Kunze, Colletotrichum gloeosporioides (Penz.) Penz. & Sacc., Emericella sp., Keissleriella sp., Lasiodiplodia theobromae (Pat.) Griffon & Maubl., Microascus sp., Microascus trigonosporus var. macrosporus G.F. Orr, Oxydothis sp., Ovatospora brasiliensis (Bat. & Pontual) X.Wei Wang & Samson e Trichoderma sp. A micota que habita as folhas do licurizeiro (S. coronata) é diversificada e essa Arecaceae mostra-se como um excelente hospedeiro para os fungos do filo Ascomycota.
Palavras-chave: Semiárido; Licuri; Taxonomia; Biodiversidade.
Follicolous Fungi in Syagrus coronata (Mart.) Becc. (Arecaceae): new registration for Brazil
Abstract: The foliar mycobiota of Syagrus coronata (Mart.) Becc. was investigated at Sítio Brejinho da Serra, Pernambuco. These palms are used in the crafting of artisanal products by the local community, with the aim of contributing to the expansion of knowledge about fungi in Arecaceae within the Caatinga biome. Leaves of S. coronata were collected during three excursions between November 2014 and July 2015. The collected material was analysed, morphologically characterised, and identified at the Science Laboratory of the State University of Bahia, Campus VIII-Paulo Afonso. Nine genera and ten species of fungi, distributed across eight families, were studied. Among the studied microfungi, phytopathogens and saprobes were found, including new records of occurrence for Brazil and for the botanical substrate analysed. The following were catalogued: Chaetomium globosum Kunze, Colletotrichum gloeosporioides (Penz.) Penz. & Sacc., Emericella sp., Keissleriella sp., Lasiodiplodia theobromae (Pat.) Griffon & Maubl., Microascus sp., Microascus trigonosporus var. macrosporus G.F. Orr, Oxydothis sp., Ovatospora brasiliensis (Bat. & Pontual) X.Wei Wang & Samson, and Trichoderma sp. The mycobiota inhabiting the leaves of the licuri palm (S. coronata) is diverse, and this Arecaceae proves to be an excellent host for fungi of the phylum Ascomycota.
Keywords: Semiarid; Licuri; Taxonomy; Biodiversity.
Hongos Folicolos en Syagrus coronata (Mart.) Becc. (Arecaceae): nuevo registro para Brasil
Resumen: Se investigó la micobiota foliar de Syagrus coronata (Mart.) Becc. en el Sítio Brejinho da Serra, Pernambuco. Se utilizaron palmeras para la confección de productos artesanales por la comunidad local, con el objetivo de contribuir a la ampliación del conocimiento sobre los hongos en Arecaceae en el bioma Caatinga. Las recolectas de hojas de S. coronata se realizaron en tres excursiones entre noviembre de 2014 y julio de 2015. En el Laboratorio de Ciencias de la Universidad del Estado de Bahía, Campus VIII-Paulo Afonso, el material recolectado fue analizado, caracterizado morfológicamente e identificado. Se estudiaron nueve géneros y diez especies de hongos, distribuidos en ocho familias. Entre los microhongos estudiados, se encontraron fitopatógenos y saprófitos, y se realizaron nuevos registros de ocurrencia para Brasil y para el sustrato botánico analizado. Se catalogaron: Chaetomium globosum Kunze, Colletotrichum gloeosporioides (Penz.) Penz. & Sacc., Emericella sp., Keissleriella sp., Lasiodiplodia theobromae (Pat.) Griffon & Maubl., Microascus sp., Microascus trigonosporus var. macrosporus G.F. Orr, Oxydothis sp., Ovatospora brasiliensis (Bat. & Pontual) X.Wei Wang & Samson y Trichoderma sp. La micobiota que habita las hojas del licurí (S. coronata) es diversa y esta Arecaceae se muestra como un excelente hospedador para los hongos del filo Ascomycota.
Palabras clave: Semiárido; Licurí; Taxonomía; Biodiversidad.
INTRODUÇÃO
A Caatinga é um bioma exclusivamente brasileiro, ocupando uma área de aproximadamente 850.000 km², cerca de 10% do território nacional (Drumond et al., 2012). Levantamentos de fauna e flora mostram que o bioma possui um considerável número de espécies endêmicas, ou seja, que ocorrem somente nesta região, e que devem ser consideradas como um patrimônio biológico de valor incalculável (Kiill, 2002). No entanto, levantamentos da funga ainda são incipientes.
A palmeira Syagrus coronata (Mart.) Becc. é endêmica do Brasil, e encontrar-se na região nordeste (Alagoas, Bahia, Pernambuco, Sergipe) e sudeste (Minas Gerais), podendo ser localizada nas vegetações Caatinga e Cerrado (Leitman et al., 2015). O licuri apresenta grande importância nos municípios onde se encontra, pois representa fonte de renda para a população, no entanto a sua exploração ainda se dá de forma extrativista (Ramalho, 2008).
Das folhas do licuri são confeccionados chapéus, vassouras, espanadores, sacolas, esteiras, sendo ainda usadas na cobertura de casebres, e na produção de utensílios artesanais diversos (Bondar, 1942; Noblick, 1986). As folhas são órgãos vegetais responsáveis pelo processo de fotossíntese, uma vez que nelas está concentrada a clorofila, conferindo a cor predominantemente verde; além disso, são estruturas laminares e finas que aperfeiçoam o aproveitamento solar (Souza et al., 2013). Os fungos podem ser encontrados nas folhas, colonizando a superfície ou o tecido foliar.
Os fungos são importantes, tanto do ponto de vista ecológico quanto econômico. Ecologicamente, são considerados os lixeiros do mundo, pois degradam todo tipo de restos orgânicos, independente da origem, transformando-os em elementos assimiláveis pelas plantas. Já, economicamente, têm implicações em várias áreas: medicina humana e veterinária, farmácia, nutrição, fitopatologia, agricultura, biotecnologia, entre outras (Silveira, 1995).
De acordo com Maia et al., (2015) a diversidade de fungos no Brasil é pouco estudada, tendo o domínio Caatinga 999 espécies registradas e o Estado de Pernambuco 1611 táxons descritos e catalogados. No entanto, estudos sistematizados acerca da diversidade de fungos associados ao licuri (S. coronata) no bioma Caatinga têm sido realizados nos últimos anos, revelando uma riqueza de espécies da micota pesquisada (Fortes et al., 2020; Fortes & Vitória, 2022; Santos et al., 2016, 2019, 2020; Vitória et al., 2016, 2020, 2022; Santos & Vitória, 2017; Rocha & Vitória, 2020), no estado da Bahia, na Ecorregião Raso da Catarina.
No estado de Pernambuco estudos sobre fungos que colonizam o licuri ainda são incipientes, em face do pouco conhecimento em torno da micota dessa palmeira, este trabalho teve por objetivo realizar um estudo taxonômico dos fungos associados à S. coronata no Sítio Brejinho da Serra, Pernambuco, Brasil.
MATERIAIS E MÉTODOS
Local de Coleta
O Sítio Brejinho da Serra está localizado no município de Petrolândia, Mesorregião do São Francisco Pernambucano, microrregião Itaparica, limitando-se ao Norte com município de Floresta, ao sul com Jatobá, a Leste com Tacaratu e a Oeste com o Estado da Bahia, estando a 428 km da capital pernambucana, Recife (IBGE, 2015), próximo às margens do Rio São Francisco (Castañeda, 2010). A sede do município está 282 metros de altitude em relação ao nível do mar e tem sua posição geográfica determinada pelo paralelo de 09º 04' 08" W e 38º 18' 11" S, seu clima é Semiárido quente (classificação de Köppen) com temperatura média anual de 27°, sua vegetação é Caatinga Hiperxerófila (IBGE, 2015).
Procedimento de coleta e Análise do Material Coletado
As coletas das folhas de S. coronata no Sítio Brejinho da Serra foram realizadas durante três excursões entre novembro/2014 e julho/2015. Vinte indivíduos foram marcados e georreferenciados na amostragem. Para o levantamento da micota desses indivíduos, foram coletadas: folhas jovens, folhas maturas e folhas secas, todas presas à planta (figura 1).

Figura 1: A - C Folhas de licuri. A. Folha jovem. B. Folha em fase de maturação (seta lâmina foliar). C. Folha seca (seta raque foliar). Fotos: Batista, T.D.C.
Em seguida, as folhas foram fracionadas em tamanhos padronizados de aproximadamente 20 centímetros de comprimento, com auxílio da tesoura de poda. Posteriormente as amostras foram acondicionadas em sacos de papel tipo Kraft, devidamente identificados com os seguintes dados: local, data da coleta, número do indivíduo e tipo de folha.
Os espécimes foram encaminhados para o laboratório de Ciências da Universidade do Estado da Bahia, Campus VIII, Paulo Afonso, Bahia. O material foi lavado em água corrente para remoção de possíveis contaminantes e em seguida foram colocados em vasilhas de plástico com tampa e recobertos com papel filtro umedecidos com água destilada estéril (câmara úmida). As câmaras úmidas permitem aeração adequada para a respiração e menor probabilidade de contaminação, favorecendo o desenvolvimento dos fungos.
A análise topográfica do material foi realizada em estereomicroscópios (Carl – Zeiss serie-Nr 3919021881). Os fragmentos das microestruturas fúngicas foram retirados com o auxílio de agulha de ponta fina (tipo insulina) e montado entre lâmina e lamínula, utilizado lactofenol com adição de corante (azul de algodão), reagente de Melzer e água.
As lâminas preparadas foram observadas ao microscópio (Zeiss modelo – Axiovert 40 CFL) em diversos aumentos para caracterização das estruturas morfológicas do fungo, as quais foram medidas na objetiva de 40× com auxílio de um micrômetro ocular no laboratório de Biologia Vegetal da UNEB. As fotomicrografias foram realizadas com a utilização de uma câmera fotográfica digital (Sony, 16.2 megapixeis).
A identificação do material foi realizada com o auxílio de chaves taxonômicas em literatura especializada (Fröhlich & hyde, 2000; Hyde, 1994; Hyde, 1996; Hyde & Cannon, 1999; Vitória et al., 2012; Ames, 1961; Doveri, 2013; Barnett & Hunter, 1998; Barr, 1990; Sutton, 1980; von Arx et al., 1988).
Todo material identificado foi depositado na coleção micológica do Laboratório de Micologia da UNEB Campus VIII: Coleção Didática, Herbário de Fungos e Coleção de Cultura de Fungos (MICOLAB-UNEB VIII).
RESULTADOS E DISCUSSÃO
Nas folhas de licurizeiros coletadas e analisadas nove gêneros e dez táxons de fungos, distribuídos em oito famílias e nove ordens foram identificados (Tabela 1). Dos fungos identificados, três são anamórficos e sete teleomorfos. Os fungos anamórficos apresentam formas filamentosas ou leveduriformes, possui reprodução assexual através de estruturas como setas, células de separação, vesículas, esclerócios, clamidósporos, bulbilhos, apressórios, haustórios, entre outras (Bononi & Grandi, 1999). Enquanto os fungos teleomorfos apresentam reprodução sexuada por formação de esporos por meiose (Alexopoulos et al., 1996).
Tabela 1: Distribuição taxonômica dos táxons catalogados, estádio sexual e registros de ocorrência.
Táxons |
| Família |
| Ordem |
| Estádio sexual |
| Registro de ocorrência (substrato) |
|
|
|
|
|
|
|
|
|
Chaetomium globosum Kunze |
| Chaetomiaceae |
| Sordariales |
| Teleomorfo |
| Licuri |
Colletotrichum gloeosporioides (Penz.) Penz. & Sacc. |
| Glomerellaceae |
| Glomerellales |
| Anamorfo |
| Espécies Arecaceae |
Emericella sp. |
| Aspergillaceae |
| Eurotiales |
| Teleomorfo |
| Licuri |
Keissleriella sp. |
| Lentitheciaceae |
| Pleosporales |
| Teleomorfo |
| Primeiro registro do gênero para o Brasil |
Lasiodiplodia theobromae (Pat.) Griffon & Maubl. 1909 |
| Botryosphaeriaceae |
| Botryosphaeriales |
| Anamorfo |
| Espécies Arecaceae |
Microascus sp. |
| Microascaceae |
| Microascales |
| Teleomorfo |
| Licuri |
Microascus trigonosporus var. macrosporus G.F. Orr |
| Microascaceae |
| Microascales |
| Teleomorfo |
| Primeiro registro da espécie colonizando o licuri |
Oxydothis sp |
| Oxydothidaceae |
| Xylariales |
| Teleomorfo |
| Espécies Arecaceae |
Ovatospora brasiliensis (Bat. & Pontual) X.Wei Wang & Samson |
| Chaetomiaceae |
| Sordariales |
| Teleomorfo |
| Primeiro registro para o licuri |
Trichoderma sp. |
| Hypocreaceae |
| Hypocreales |
| Anamorfo |
| Primeiro registro do gênero colonizando licuri |
|
|
|
|
|
|
|
|
|
Total |
| 8 |
| 8 |
| 2 |
| 10 |
Os licurizeiros (S. coronata) no Sítio Brejinho da Serra servem de base para a economia da população, onde a palha ou folhas são utilizadas na confecção de bolsas e vassouras, técnica que consiste no trançado da palha, fibra vegetal (Figura 2).

Figura 2 A - I- Processo artesanal com as folhas de S. coronata (licuri). A - Coleta das folhas jovens para construção das bolsas. B - Folhas jovens ao sol para que ocorra a desidratação. C - Folhas secas, sendo trançadas. D – F. Trança: detalhes das tranças (Nó inicial e pontos da trança). G - Bolsa artesanal confeccionada com as folhas jovem desidratada. H – I - Vassoura confeccionada com as raques das folhas jovens. Fotos: Batista, T.D.C.
Os fungos encontrados nas folhas jovens foram C. globosum e O. brasiliensis. Nas folhas em fase de maturação foram identificados O.brasiliensis, C. globosum, Keissleriella sp., M. trigonosporus var. macrosporus, Trichoderma sp., Emericella sp. C. gloeosporioides e L. theobromae. Nas folhas secas O. brasiliensis C. globosum, M. trigonosporus var. macrosporus, Microascus sp., Oxydothis sp., C. gloeosporioides e L. theobromae.
Tabela 2: Amostragem micota em folhas de S. coronata. Folhas jovens, folhas em fase maturação e na fase seca, todas presa a planta, e distribuição no órgão vegetal (lâmina foliar e raque).
Microfungos |
| Fase jovem |
| Fase maturação |
| Fase seca |
| Lâmina foliar |
| Raque |
|
|
|
|
|
|
|
|
|
|
|
Chaetomium globosum |
| 1 |
| 1 |
| 1 |
| 1 |
| 1 |
Colletotrichum gloeosporioides |
| 0 |
| 1 |
| 1 |
| 1 |
| 1 |
Emericella sp. |
| 0 |
| 1 |
| 0 |
| 1 |
| 1 |
Keissleriela sp. |
| 0 |
| 1 |
| 1 |
| 1 |
| 1 |
Lasiodiplodia theobromae |
| 0 |
| 1 |
| 1 |
| 1 |
| 1 |
Microascus sp. |
| 0 |
| 0 |
| 1 |
| 0 |
| 1 |
Microascus trigonosporus var. macroporus |
| 0 |
| 1 |
| 0 |
| 1 |
| 1 |
Oxydothis sp. |
| 0 |
| 0 |
| 1 |
| 1 |
| 1 |
Ovatospora brasiliensis |
| 1 |
| 1 |
| 1 |
| 1 |
| 1 |
Trichoderma sp. |
| 0 |
| 1 |
| 0 |
| 1 |
| 1 |
0 – Ausência microfungos
1 – Presença microfungos
A folha é o principal órgão do vegetal, Pinruan e colaboradores (2007) relatam que pecíolos e as raques fornecem um do substrato de cultivo rico em celulose e lignina, e apenas fungos com enzimas específicas podem utilizá-la como substrato, a lâmina foliar oferece amidos e açúcares para o desenvolvimento rápido.
De acordo com Carrol (1988) fungos patogênicos de folhas jovens só acarretarão lesões meses depois do contato fungo - hospedeiro, através dessa afirmação podemos levantar a hipótese de que os esporos de C. globosum e O. brasiliensis estão em todas as fases de vida das folhas no licuri para realizar a decomposição das folhas quanto estiverem secas, assim realizando sua função de decomposição, mas para que isso seja afirmado são necessários mais estudos com isolamento da micota. Na fase de maturação foram encontradas todas as espécies catalogadas, exceto Microascus sp., foram identificadas espécies endofiticas patogénicas como C. gloeosporioides e L. theobromae, nesse trabalho consideramos que essas espécies estavam vivendo de formar harmônica com o substrato pois não foi notado nenhum dano, e para verificar o grau de prejuízo dessa relação são necessários testes com os microfungos para determinado fim, há outra hipótese que foi levantada através do trabalho de Pereira (1993) onde é relatado que os fungos patogênicos podem está presente para proteção do hospedeiro contra vírus, insetos e outros organismos. Emericella sp. e Trichoderma são espécies que atuam no controle biológico de outros fungos causadores de doenças como a fusariose. Microascus trigonosporus var. macroporus nas amostragens está nas folhas em fase de maturação na raque e lâmina foliar. Nas folhas secas estavam presentes várias espécies em comum com a folha em estágio de maturação. A única espécie exclusivamente encontrada na raque da folha seca foi Microascus sp., presente na parte mais lignificada da folha, é um gênero com espécies oportunistas em humanos e decompositores em vegetais.
Chave taxonômica para espécies de microfungos presentes na micota foliar de S. coronata no Brejinho da Serra, Pernambuco.
1a. | Anamorfo.......................................................................... | ...............................2
|
1b. | Teleomorfo........................................................................ | ...............................4
|
2ª. | Conidióforos nas superfícies do substrato, verdes, filiádes retas ampuliformes; conídios globosos........................................................................... | 10.Trichoderma sp.
|
2b. | Conidiomas submersos no substrato, marrons; sem filiádes............................................................................... | ...............................3
|
3a. | Conídios ovoides hialinos jovens, enegrecidos maturo com estria longitudinal...................................................... |
......5. Lasiodiplodia theobromae
|
3b. | Conídios cilíndricos com ápice arredondado..................................................................... |
...2. Colletotrichum gloeosporioides
|
4a. | Ascoma na superfície ou imerso no substrato................... | ...............................5
|
4b. | Ascoma exclusivamente imerso no substrato................... | ...............................9
|
5a. | Ascoma cleistotecial, oblongos; presença de células de Hulle; ascósporos estrelados............................................ | .....3 .Emericella sp.
|
5b. | Ascomas oblongos com coloração cinza ou enegrecidas com pelos ou não............................................................. | ...............................6
|
6a. | Ascomas com pelos........................................................ | ...............................7
|
6b. | Ascomas sem pelos.......................................................... | ..............................8
|
7a. | Peritécio globoso, enegrecido piloso ondulado; ascósporo oval a subgloboso........................................... |
.......1. Chaetomium globosum
|
7b. | Peritécio ovoide, acinzentado piloso espiralado; ascósporo oval................................................................. |
.........9. Ovatospora brasiliensis
|
8a. | Ascósporo superficial ou imerso, pescoço curto; ascósporos reniformes..................................................... | ...6. Microascus sp.
|
8b. | Ascoma superficial, pescoço longo; ascósporos triangulares....................................................................... |
.........7. Microascus trigonosporus var. macrosporus |
9a. | Ascos clavados bitunicados; ascósporos fusiformes com septos e dois apêndices nas extremidades....................... | ..4. Keissleriella sp.
|
9b. | Ascos unitunicados pedicelados parafisados; ascósporos filiformes – fusoídes...................................... | .....8. Oxydothis sp.
|
TAXONOMIA
1) Chaetomium globosum Kunze, in Kunze & Schmidt, Mykologische Hefte (Leipzing) 1:16 (1817)
Figuras 3 A ˗ 4 A
Descrição: Peritécio 250 ˗ 300 μm diam., globoso, enegrecidos, inteiramente piloso, com pelos ondulados. Perídio muito fino. Pelos terminais ondulados, 3.5 μm de diam., coloração enegrecida, pelos na base semelhantes aos pelos terminais mais curtos. Ascos unitunicados, clavado, 22.5 ˗ 62.5 μm alt. × 7.5 ˗ 27.5 μm compr., com 8 ascósporos. Ascósporos, oval a subgloboso, 7.5 ˗ 15.0 μm alt. × 7.5 ˗ 12.5 μm larg., quando jovem hialino, quando maturo marrons a acinzentados.
Nota: A espécie C. globosum foi identificada de acordo com Ames (1961) e Doveri (2013). O material foi colocado em câmara úmida. Conforme Melo (2015), os caracteres taxonômicos para identificação da espécie são: peritécios globosos a subglobosos inteiramente cobertos por pelos ondulados a arcuados e ascósporos ovóides, subglobosos, levemente apiculados.
Distribuição: Cosmopolita
Ocorrência no Brasil: Pernambuco e São Paulo
Habitat: Registrada em solo, material vegetal, produtos têxteis, em excrementos de vários herbívoros e licuri.
Material examinado: BRASIL. PERNAMBUCO: Sítio Brejinho da Serra, Petrolândia, em lâmina foliar e raque de S. coronata (Licuri), 11/12/2014, Batista, T. D. C., 9° 7’ 87,1” S e 38°16’13,1” W (MICOLAB 0301)
2) Colletotrichum gloeosporioides (Penz.) Penz. & Sacc., Atti Inst. Veneto Sci. lett., ed Arti, Sér. 6 2: 670 (1884)
Figuras 3 B ˗ 4 B
Descrição: Conidiomas imerso na superfície do hospedeiro, em secção vertical 125 ˗ 200 × 162.5 ˗ 225 μm de comprimento. Conídios 25 ˗ 37.5 × 7 ˗ 10 μm, retos, cilíndricos de ápices arredondados, unicelular.
Nota: Após realizar câmara úmida a espécie foi identificada de acordo com Barnett e Hunter (1998). Na descrição original há presença de setas ou cerdas, mas de acordo com Menezes (2006), no seu trabalho intitulado “aspectos biológicos e taxonômicos de espécies do gênero Colletotrichum” foi discutido que a formação de setas não é uma característica estável, variando de acordo com as condições do ambiente físico e nutricional, admitindo-se que a seta não possuía valor taxonômico, para separação dos gêneros Colletotrichum e Gloeosporium. Trata-se de um fungo anamorfo e a característica básica para identificação da espécie é a morfologia do conídio cilíndrico, com ápice arredondado e unicelular (Menezes, 2006). Colletotrichum gloeosporioides possui 231 hospedeiros, de acordo com a Embrapa (2015). A espécie C. gloeosporioides pode atacar os mais diversos hospedeiros, nos mais diversos estádios de desenvolvimento da planta (Benato, 1999). Nas espécies de Colletotrichum são encontradas formas sapróbias e patogênicas, sendo estas últimas, responsáveis por doenças economicamente importantes, comumente denominadas de antracnoses (Menezes, 2006). Este é o primeiro registro de C. gloeosporioides para o licurizeiro, mas de acordo com dados do SMML (Fungus-Host Distributions) já foi identificado em outras palmeiras (Cocos nucifera L., Phoenix L., Euterpe edulis Mart., Euterpe oleracea Mart.).
Distribuição: Cosmopolita
Ocorrência no Brasil: Distrito federal, Pernambuco, Maranhão, Minas Gerais, Goiás, Rondônia, Amazonas, Rio de Janeiro, Amapá, Bahia, Ceará, Piauí, São Paulo, Paraná, Alagoas, Mato Grosso do Sul, Acre, Pará, Espírito Santo, Santa Catarina, Paraíba, Mato Grosso
Substrato: Material vegetal e licuri
Material examinado: BRASIL. PERNAMBUCO: Sítio Brejinho da Serra, Petrolândia, em lâmina foliar e raque de S. coronata (Licuri), 13/06/2015, Batista, T. D. C., 9°7’ 20,0” S 38°15’97,0” W (MICOLAB 0302)
3) Emericella sp.
Figuras 3C ˗ 4E ˗ 4 F
Descrição: Ascoma cleistotecial oblongos na superfície do hospedeiro, com coloração verde-limão, medindo 365 ˗ 785.5 × 360 ˗ 790 μm. Células Hülle oblongas a esféricas, hialinas, medindo 17.5 ˗ 22.5 μm diam. Asco globoso a subgloboso, medindo 11.5 ˗ 15.5 μm diâmetro, com 8 esporos. Ascósporos estrelados, vermelhos a marrons, medindo 3.7 ˗ 5 × 3 ˗ 4.5 μm.
Nota: Após a análise do material que estava em câmara úmida o gênero Emericella foi identificado de acordo com Moubasher e colaboradores (2013), podendo ser facilmente reconhecido por apresentar ascósporos estrelados. Emericella sp. foi registrada apenas em Anacardium occidentale L. popularmente conhecido como cajueiro. Existe registro da espécie Emericella nidulans em Piper nigrum L. (Hochst.) (pimentão) (EMBRAPA, 2015). De acordo com Simbounnavong et al., (2008), no seu trabalho “The new antagonistic fungus, Emericella nidulans strain EN against Fusarium Wilt of Tomato” a espécie E. nidulans é um fungo usado como controle biológico, controlando o desenvolvimento de outros fungos que causam fusariose, antractonose na plantação de tomate.
Distribuição: Argentina, Espanha e Brasil
Ocorrência no Brasil: Pernambuco
Substrato: Plantas
Material examinado: BRASIL. PERNAMBUCO: Sítio Brejinho da Serra, Petrolândia, em lâmina foliar e raque de S. coronata (Licuri), 11/12/2014, Batista, T. D. C., 9°7’86,8” S 38°16’0,57” W (MICOLAB 0303)
Figuras 3 D ˗ 4 K
Descrição: Ascoma imerso, 175 ˗ 250 μm diam., ápice rompendo a superfície do hospedeiro, curto papilado com células enegrecidas. Perídio 12.5, marrom. Asco 65 ˗ 87.5 × 7.5 ˗ 17.5 μm, clavado, bitunicado, 8 ascósporos fusiformes 15 ˗ 27.5 × 5 ˗ 7.5 μm, envolto com bainha 2.5 ˗ 3 μm diam., quando jovem hialino, quando maturo marrom apresentando um septo e dois apêndices nas extremidades.
Nota: O táxon mais próximo do material examinado morfologicamente foi Keissleriella. O material analisado foi identificado de acordo com Barr (1990), o gênero possui caracteres morfológicos em conformidade com Keissleriella sp., Barr (1990) relata que esse gênero foi encontrado colonizando substrato lenhoso e seu hábito de vida é sapróbio. Os caracteres morfológicos para o reconhecimento do gênero é ascoma imerso, com um pequeno ostíolo papilado na superfície do hospedeiro ou com cerdas curtas; asco clavado com 8 esporos elípticos fusiforme de cor hialina ou marrom. Esse é o primeiro registro de Keissleriella sp. colonizando um representante da família Arecaceae no Brasil.
Distribuição: Áustria, Suíça, Carolina do Norte, Suécia, Inglaterra, Itália, Reino Unido, Polônia, Paquistão e Países Baixos
Ocorrência no Brasil: Pernambuco no presente trabalho
Substrato: Substrato lenhoso
Material examinado: BRASIL. PERNAMBUCO: Sítio Brejinho da Serra, Petrolândia, em lâmina foliar de S. coronata (Licuri), 11/12/2014, Batista, T. D. C., 9°7’ 20,0” S 38°15’97,0” W (MICOLAB 0304)
5) Lasiodiplodia theobromae (Pat.) Griffon & Maubl., Bull. Soc. mycol. Fr. 25: 57 (1909)
Figuras 3 E ˗ 4 H ˗ 4 G
Descrição: Conidiomas submersos tornando-se superficiais no seu hospedeiro; em secção vertical 205 ˗ 325 × 200 ˗ 275 μm de comprimento. Conídios 22.5 ˗ 27.5 × 12.5 ˗ 15 μm, unicelulares, ovoides, hialinos quando jovens, marrons quando maduros, com estrias longitudinais, 1 ˗ septado.
Nota: A espécie estudada foi identificada de acordo com a chave fornecida por Sutton (1980). Trata-se do fungo L. theobromae que tem sido frequentemente isolada como endofítico em folhas e folíolos de inúmeras plantas nos Estados do Ceará e de Pernambuco, (Mariano et al., 1997). Este fungo já foi registrado para 101 hospedeiros, pode ser encontrado em plantas e outros substratos como sapróbio ou parasita colonizando plantas com um grande potencial econômico, como: cajueiro, laranjeira, bananeira, maracujá, cacau entre outros (EMBRAPA, 2015). Este gênero se distingue pelos conidiomas estromaticos imersos, com células conidiogenas holoblasticas, produzindo inicialmente conídios hialinos, de parede fina, mas quando maduros, tornando-se marrons negros, de parede espessa, com um septo mediano e estrias longitudinais (Sutton, 1980).
Lasiodiplodia theobramae pode causar diversos sintomas nas plantas infectadas, incluindo seca-descendente (die-back), cancro em ramos, caules e raízes, lesões em estacas, folhas, frutos e sementes, além causar a morte de mudas e enxertos (Freire et al., 2015). É um fungo com distribuição cosmopolita, considerado polífago e oportunista, assim podem causar lesões em seus hospedeiros quando são submetidos a ferimentos naturais ou causado por ações humanas para uso cultural (Pereira et al., 2006). Lasiodiplodia theobromae foi identificado em áreas de Mata Atlântica no Nordeste do Brasil associados à palmeira Bactris hirta (tucum-mirim) (Vitória et al., 2012).
Neste trabalho, L. theobromae foi encontrado como sapróbio, após realização de câmara úmida.
Distribuição: Amplamente distribuídas em regiões tropicais e subtropicais
Ocorrência no Brasil: Maranhão, Pernambuco, Santa Catarina, Amazonas, Pará, Bahia, Rio Grande do Norte, Paraíba, Ceará, Alagoas, Minas Gerais, Roraima, Goiás, Distrito Federal, São Paulo, Paraná, Rondônia e Piauí
Substrato: Plantas vivas
Material examinado: BRASIL. PERNAMBUCO: Sítio Brejinho da Serra, Petrolândia, em lâmina foliar e raque de S. coronata (Licuri), 11/12/2014, Batista, T. D. C., 9°7’31,2” S e 38°16’0,51” W (MICOLAB 0305)
6) Microascus sp.
Figuras 3 F ˗ 4 I
Descrição: Ascoma superficial ou imerso, esférico, enegrecido com um ostíolo medindo 237.5 ˗ 375 × 240 ˗ 377.5 μm de diâmetro, com pescoço curto 2.5 μm compr. Perídio composto por células angulares, finas, marrons em vista frontal. Asco oval a esférico, 8 esporos, evanescente, com 20 ˗ 22.5 μm de diâmetro. Ascósporos reniformes, com extremidades arredondadas, quando jovem cor amarelo clara, e quando maduro marrom claro, medido 7.5 ˗ 10 × 2.5 ˗ 5.0 μm.
Nota: O espécime examinado foi identificado como Microascus sp. de acordo com von Arx et al. 1988. As principais características para identificação do gênero são: ascoma enegrecido com ostíolo e ascósporos pequenos unicelulares, de coloração amarelada, liso. Possui espécies que vivem no solo, fezes, em ambientes como casa ou apartamento e algumas espécies são reconhecidas como oportunistas em animais e no homem (Piontelli, 2015). O fungo em questão foi encontrado colonizado a raque das folhas de S. coronata.
Distribuição: Brasil
Ocorrência no Brasil: Pernambuco e Ceará
Substrato: Solo, fezes, animais e podem ser encontrados causando doenças em humanos, Ar atmosférico e plantas.
Material examinado: BRASIL. PERNAMBUCO: Sítio Brejinho da Serra, Petrolândia, em raque de S. coronata (licuri), 11/12/2014, Batista, T. D. C., 9°7’86,8” S 38°16’0,57” W (MICOLAB 0306)
7) Microascus trigonosporus var. macrosporus G.F. Orr, Can. J. Bot. 39: 1617 (1961)
Figuras 3 G ˗ 4 D
Descrição: Ascoma superficial, esférico, enegrecido com um ostíolo com 150 ˗ 265.5 μm de diâmetro, com pescoço longo 5 μm compr. Perídio composto por células angulares, finas, marrons em vista frontal. Asco oval a esférico, 8 esporos, evanescente, com 12.2 ˗ 15 × 15 μm de diâmetro. Ascósporos triangular, na lateral com extremidades arredondadas, quando jovem cor pálida, e quando maduro marrom claro a alaranjado medido 5 ˗ 7.5 × 5 ˗ 7.5 μm.
Nota: O espécime examinado identificado como Microascus trigonosporus var. macrosporus de acordo com von ARX et al., 1988. Microascus trigonosporus var. macrosporus pode ser facilmente reconhecida por apresentar peritécio superficial, esférico e enegrecido, ascósporos triangulares. Uma variação com ascósporos maiores, 5.5 ˗ 7.5 × 5 ˗ 6.5 μm, como M. trigonosporus var. macrosporus (von Arx et al., 1988). Também considerado um fungo causador de infecções fúngicas e oportunistas em pacientes imunocomprometidos, quando assume sua forma assexual denomina Scopulariopsis trigonospora (Cortiñas et al., 2013).
Distribuição: Cosmopolita
Ocorrência no Brasil: Pernambuco
Substrato: Solo, penas de aves, matéria vegetal e insetos, ar atmosférico
Material examinado: BRASIL. PERNAMBUCO: Sítio Brejinho da Serra, Petrolândia, em lâmina foliar e raque de S. coronata (licuri), 11/12/2014, Batista, T. D. C., 9°7’30,9” S 38° 16’0,53” W, (MICOLAB 0307)
8) Oxydothis sp.
Figuras 3 H ˗ 4 L
Descrição: Ascomas imersos, com pontos enegrecidos, papilados, na superfície do hospedeiro. Secção vertical 127.5 ˗ 250 μm alt. × 112.5 ˗ 162.5 μm larg., lenticulares, ostiolados. Ascos 110.0 ˗ 237.5 μm alt. × 10 ˗ 15.0 μm larg., unitunicados, 8 ˗ esporos, pedicelados, parafisados, com um anel subapical I ˉ, 2.5 × 7.5 μm. Ascósporos 102 ˗ 125 μm alt. × 5 ˗ 7.5 μm compr., filiforme-fusoides, 1 ˗ septados, hialinos.
Nota: O material analisado foi identificado de acordo com a chave fornecida por Hyde (1994). Podem ser sapróbios, endofíticos ou parasitas de membros da Gramineae, Liliaceae, Palmeiras e Pandanaceae (Hyde et al., 2000). Características relevantes para a caracterização do gênero são: ascósporos fusiformes, ou filiformes, com extremidades como espinha ou apiculadas, alguns com extremidades arredondadas e com bainha mucilaginosa, 1 ˗ septados, lisos (Fröhlich e Hyde, 2000). De acordo com dados divulgados pela Embrapa (2015) e Species Link, o gênero Oxydothis foi encontrado colonizando as palmeiras: Euterpe oleracea Engel, Euterpe edulis Martius, Mauritia flexuosa L. f. e Elaeis guineenses A. Chev.
Distribuição: Tailândia, Índias Ocidentais, Japão, Indonésia e Brasil
Ocorrência no Brasil: Bahia, Pernambuco e Rio Grande do Sul
Substrato: Plantas
Material examinado: BRASIL. PERNAMBUCO: Sítio Brejinho da Serra, Petrolândia, em lâmina foliar e raque de S. coronata (licuri), 11/12/2014, Batista, T. D. C., 9° 7’ 87,1” S e 38°16’13,1” W (MICOLAB 0308)
9) Ovatospora brasiliensis (Bat. & Pontual) X.Wei Wang & Samson, em Wang, Houbraken, Groenewald, Meijer, Andersen, Nielsen, Crous & Samson, Stud. Mycol. 84: 207
Figuras 3 I ˗ 4 C
Descrição: Peritécio 150 μm diam., ovoide ou subgloboso, acinzentados, inteiramente piloso, com pelos enrolados a espiralados. Perídio muito fino, camada externa com textura angulares. Pelos terminais espiralados, 2 ˗ 2.5 μm diam., coloração acinzentada, pelos da base semelhante aos pelos terminais mais esparsos. Asco unitunicado, não-amiloide, cilíndrico, 60 ˗ 70 μm alt. × 7 ˗ 9 μm larg., com 8 ascósporos. Ascósporos 6 ˗ 7 alt. × 4 ˗ 6 μm larg., oval, quando jovem hialino, quando maturo marrom.
Nota: Após a realização de câmara úmida a espécie foi identificada de acordo com Doveri (2013) e Ames (1963). O. brasiliensis é um fungo coprófilo, apresentando características diagnosticas como: ascos cilíndrico-lineares, peritécios pequenos (110 ˗ 150 × 90 ˗ 140 μm), ovóides à subglobosos, com pelos rugosos, ondulados ou encaracolados, simples ou ramificados (Melo, 2015). No Brasil, Chetomium brasiliense foi catalogado no estado de Pernambuco, por Batista e Pontual, no Boletim da Secretaria de Agricultura Indústria e Comércio do Estado de Pernambuco em 1948, mas em 2016 através de estudos filogenéticos modernos ocorreu a alteração da espécie para O. brasiliensis (Al-Dossary et al., 2016). Este é o primeiro registro para o hospedeiro S. coronata.
Distribuição: Índia, Estados Unidos, Paquistão, Brasil, Iraque
Ocorrência no Brasil: Pernambuco
Habitat: Registrado em excrementos de cobaia e em material vegetal, primeiro registro em licuri
Material examinado: BRASIL. PERNAMBUCO: Sítio Brejinho da Serra, Petrolândia, em lâmina foliar e raque de S. coronata (licuri), 11/12/2014, Batista, T. D. C., 9° 7’ 87,1” S e 38° 16’ 13,1” W (MICOLAB 0300)
10) Trichoderma sp.
Figuras 3 J ˗ 4 J
Descrição: Conidióforos mononematosos, 22.5 ˗ 100 μm de comprimento, lisos, apresentando ramificações verticiladas curtas, sem projeções estéreis. Fiálides retas, ampuliformes, medindo ca. 7.5 ˗ 10.5 μm compr. Conídios globosos, verdes, 2.5 μm diâmetro.
Nota: O espécime foi identificado de acordo com Samuels (2015). Os conidióforos deste gênero são repetidamente ramificados, muitas vezes irregularmente dobrados, com alongamentos de hifas estéreis, fiálides em forma de balão, obovoide em cachos terminais pequenos, geralmente facilmente reorganizada pelo seu rápido crescimento, colônias brancas ou branco-verde.
De acordo com a Embrapa (2015), Trichoderma sp. já foi encontrado no hospedeiro Elaeis guineensis Jacq. (Dendê) um representante da família Arecaceae. E esse é o primeiro registro desse fungo no hospedeiro Syagrus coronata (licuri).
Distribuição: Cosmopolita
Ocorrência no Brasil: Pernambuco, São Paulo, Bahia, Minas Gerais, Santa Catarina, Paraná, Paraíba, Rio Grande do Sul, Goiás, Distrito Federal, Ceará, Rio de Janeiro, Mato Grosso do Sul, Piauí, Pernambuco, Sergipe, Pará, Alagoas e Maranhão
Substrato: Plantas
Material examinado: BRASIL. PERNAMBUCO: Sítio Brejinho da Serra, Petrolândia, em lâmina foliar e raque de S. coronata (licuri), 11/12/2014, Batista, T. D. C., 9°7’86,8” S 38°16’0,57” W (MICOLAB 0309)

Figura 3 A – J. Táxons identificados. A. Chaetomium globosum B. Colletotrichum gloeosporioides C. Emericella sp. D. Keissleriella sp. E. Lasiodiplodia theobromae F. Microascus sp. G. Microascus trigonosporus var. macrosporus H. Oxydothis sp. I. Ovatospora brasiliensis J. Trichoderma sp. Fotos: Batista, T.D.C.
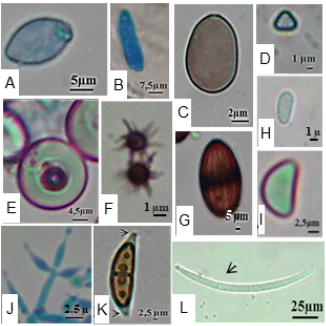
Figura 4 A – L Morfologia dos esporos dos microfungos identificados e célula de Hülle. A Chaetomium globosum B Colletotrichum gloeosporioides C Ovatospora brasiliensis D Microascus trigonosporus var. macrosporus E Células de Hulle Emericella sp. F Emericella sp. G Esporo em fase de maturação Lasiodiplodia theobromae H Esporo jovem Lasiodiplodia theobromae I Microascus sp. J Trichoderma sp. K Keissleriella (setas – apêndices nas extremidades) L Oxydothis sp. Fotos: Batista, T.D.C.
CONCLUSÃO
A palmeira S. coronata, o licuri, conhecida como a “árvore salvadora da vida” é uma das principais espécies da família Arecaceae nativa do semiárido brasileiro, desempenhando um relevante papel sociobioeconômico para a subsistência do sertanejo. Conhecer a micota desse hospedeiro contribui para a ampliação do conhecimento acerca da biodiversidade da funga brasileira. Além disso, pesquisas de cunho taxonômico também podem contribuir para otimizar estratégias de manejo e conservação do hospedeiro.
REFERÊNCIAS
Al-Dossary, M.; Almyah, M. K.; Raheem, S. S. Molecular identification of five species of Family Chaetomiaceae (Sordariomycetes, Ascomycota) from Iraqi soil. Journal of Biological Diversity, (3) 22, 10.13057/biodiv/d220325, 2016.
Alexopoulos, C. J.; Mims, C.W.; Blackwell, M. Introductory Mycology. Nova York. EUA, 1996.
Ames, L. M. A monograph of the Chaetomiaceae. 1 ed. Editora: Army Research. Estados Unidos, 1961.
Barnett, H. L.; Hunter, B. B. Ilustrated Genera of Inperfect Fungi; APS: PRESS the Americam. 4. ed. Fourth edittion, 1998.
Barr, M. E. Melanommatales (Loculoascomycetes). North American Flora. Novo York Botanical Garden Press, Bronx, NY, 1990.
Batista, A. C.; Pontual, D. Alguns fungos do gênero Chaetomium. Boletim da Secretaria de Agricultura Indústria e Comércio do Estado de Pernambuco, Brasil. (15) 62-73. 1948.
Benato, E. A. Controle de doenças pós-colheita em frutas tropicais. Summa Phytopathologica, (25): 112, 1677 - 1915, 1999.
Bondar, G. O. As ceras do Brasil e o licuri (Cocos coronata Mart.) na Bahia. Salvador. Instituto de fomento econômico da Bahia. Boletim técnico n° 11. 86 p. 1942.
Carrol, G. Fungal endophythes in stems and leaves: from latent pathogen to mutualistic symbiont. Ecology (1) 69. 1943154. 1988.
Castañeda, P. A. A etnobotânica do sistema de cura dos Índios Pankararú, Pernambuco, Brasil. 154 f. Dissertação mestrado ecologia - Universidade Federal de Pernambuco, Recife. 2010.
Cortiñas, D. C.; Rodríguez, R. F.; Lama, A. C.; López, M. D. D. Celulitis por Microascus trigonosporus (anamorfo Scopulariopsis trigonospora). Caso clínico. Sociedade Galega de Medicina Interna, 74 (2), 0304 – 4866. 2013.
Doveri, F. An additional update on the genus Chaetomium with descriptions of two coprophilous species, new to Italy. Mycosphere, 4 (4): 820 – 846, 2013.
Drumond, M. A.; Schisteck, H.; Seiffarth, J. A. Caatinga um bioma exclusivamente brasileiro... e o mais frágil. Instituto Humanitas Unisinos. Rio Grande do Sul, n. 389, 2012. Disponível em: https://www.ihuonline.unisinos.br/media/pdf/IHUOnlineEdicao389.pdf. Acesso em: 02 de janeiro de 2023.
Embrapa Recursos Genéticos e Biotecnológicos. Disponível em: < http://www2.sede.embrapa.br:8080/intranet/din.nsf/bvframe>. Acesso em: 7 de março 2015.
Fortes, N. G. S.; Santos, M. A. L.; Vitória, N. S. Aspiorsodaria nigerenses (Ascomycota): a new record for the Americas. Rodriguesia (71). 1590-2175. 2020.
Fortes, N. G. S.; Vitória, N. S. Novos registros de espécies de Chaetomium e semelhantes a Chaetomium (Ascomycota, Chaetomiaceae) em Syagrus coronata da Estação Ecológica do Raso da Catarina (ESEC), Caatinga, Bahia, Brasil. Mycotaxon (137) 171. 5248-134.737. 2022.
Freire, F. C. O.; Viana, F. M. O.; Cardoso, J. E.; Santos, A. A. Novos Hospedeiros do Fungo Lasiodiplodia theobromae no Estado do Ceará. EMBRAPA. 91, 1679-6535. 2004.
Fröhlich, J.; Hyde, K. D. Palm Microfungi. Fungal Diversity Research. 3 (1), 1 – 375, 2000.
Frölich, J.; Hyde, K. D. Biodiversity of palm fungi in the tropics: are global fungal diversity estimates realistic? .8. ed: Biodivers. Conserv 977 – 1004, 1999.
Hyde, K. D. Fungi from palms. VII. The genus Oxydothis from rachides of palms in North Quensland, including five new specie. Sydowia (45) 105 – 119, 1994.
Hyde, K. D.; Fröhlich, J.; Taylor, J. Diversity of ascomycetes on palms in the tropics. In: Hyde, K.D. Biodiversity of Tropical Microfungi. Hong Kong University Press, Hong Kong SAR, p. 141-156, 1997.
Hyde, K. D.; Cannon, P. F. Fungi causing tar spots on palms. Cab Intl. Nova York, EUA. 108p, 1999.
Instituto Brasileiro Geografia e Estatística. Disponível em: <http://biblioteca.ibge.gov.br/index.php/biblioteca-catalogo>. Acesso em: 30 de maio de 2015.
Kiill, L. H. P. Caatinga: patrimônio brasileiro ameaçado. Agronline.com.br. 2011 Disponível em: www.infoteca.cnptia.embrapa.br/infoteca/bitstream/doc/899060/1/Kiill2011.pdf. Acesso em: 02 de janeiro de 2023.
Leitman, P.; Soares, K.; Henderson, A.; Noblick, L.; Martins, R.C. Arecaceae in Lista de Espécies da Flora do Brasil. Jardim Botânico do Rio de Janeiro, 2015. Disponível em: http://floradobrasil2015.jbrj.gov.br/jabot/floradobrasil/FB53. Acesso em: 02 de janeiro de 2023.
Maia, L. C. et al. Diversity of Brazilian Fungi. Rodriguésia, v. 66, n. 4, p. 1033-1045, 2015.
Mariano, R. L. R.; Lira, R. V. F.; Silveira, E. B.; Menezes, M. Levantamento de fungos endofiticos e epifíticos em folhas de coqueiro no nordeste do Brasil. II. Efeito da localidade sobre a população fúngica. Agrotrópica. 10 (1), 0103-3816, 1998.
Melo, R. F. R. Fungos Coprófilos de Pernambuco. 769 f. Tese doutorado. Universidade Federal do Pernambuco, Recife. 2015.
Menezes, M. Aspectos biológicos e taxonômicos de Espécies do gênero Colletotrichum. In: Anais da Academia Pernambucana de Ciência Agronômica, 13., 2006. Academia Pernambucana de Ciências Agronômicas, Recife. Anais [...] Recife: Universidade Federal de Pernambuco, 2006. p. 170 - 179.
Moubasher, A. H.; Abdel-Sater, M. A.; Soliman, Z. Contribution to the mycobiota of Egypt Emericella stella-maris Zalar, Frisvad & Samson 2008, a new record to Egypt. Department of Botany and Microbiology, Faculty of Science and Assiut University Mycological Centre (AUMC), Assiut University, Assiut, Egypt. 2013.
Noblick, L. R. Palmeiras da Caatinga da Bahia e as potencialidades econômicas. In Simposio sobre Caatinga e sua exploração racional, Brasília, DF, 1986. Brasília, Distrito Federal, EMBRAPA, 1986. p. 99 – 115.
Pereira, A. L.; Silva, G. S.; Ribeiro, V. Q. Características fisiológicas, cultural e patogênica de diferentes isolados de Lasiodiplodia theobromae. Fitopatologia Brasileira 6 (31), 572-578. 2006.
Pereira, J. O. Fungos endofiticos dos hospedeiros tropicais Sthylosantes guianensis e Musa cavendish. 119 f. Tese doutorado. Universidade de São Paulo, Piracicaba, São Paulo, 1993.
Pinruan, U.; Kevin D.; Hyde, K. D.; Lumyong, S.; McKenzie, E. H. C.; Jones, E. H. B. G. Occurrence of fungi on tissues of the peat swamp palm Licuala longicalycata. Fungal Diversity, 157 – 173. 2007.
Piontelli, E. Especies clínicas comunes del género Scopulariopsis Bainier y taxas relacionados. Boletín de la Sociedad Micológica 30 (1). Doi: https://doi.org/10.22370/bolmicol.2015.30.1.863. 2015.
Ramalho, C. I. Estrutura da vegetação e distribuição espacial de licuri (Syagrus coronata (Mart.) Becc.) em dois municípios do Centro Norte da Bahia, Brasil. Tese de doutorado em Agronomia. Universidade Federal da Paraíba. 2008.
Rocha, P. Q.; Vitória, N. S. Novas ocorrências de Ascomicetos para a américa do Sul e Neotrópicos. Agrotrópica (32) 1. 0103 – 3816. 2020.
Samuels, G. J. Trichoderma: Systematics, the sexual state, and ecology. In: A Nature and aplication of biocontrol microbes II: Trichoderma spp., 304; Departamento of agriculture, 2005, Beltsville: U.S. Departament of agriculture, 2005. p. 120 – 206.
Santos, M. A. L.; Vitória, N. S.; Bezerra, J. L. Fungos colonizando palmeiras em áreas de Caatinga do Sertão da Bahia. Agrotrópica (28) 1. 21757-0103. 2016.
Santos, M. A. L. Ascomycota (Pezizomycotina) colonizando Syagrus coronata (Mart.) Becc. (Licuri) em Áreas de Caatinga do Sertão da Bahia, Brasil. 81f. Dissertação (Mestrado em Biodiversidade Vegetal) - Universidade do Estado da Bahia, Paulo Afonso. 2017.
Santos, M. A. L.; FORTES, N. G. S.; Silva, T. E. F.; Vitória, N. S. Ascomycota (lichenized and nonlichenized) on Syagrus coronata in the Caatinga biome: new and interesting records for Brazil and South America. Mycotaxon (134) 737. 0093–4666. 2020.
Silveira, V. D. Micologia. 5. ed: Âmbito cultural, 1995.
Souza, V. S.; Flores, T. B.; Lorenzi, H. Introdução à Botânica: morfologia. 1. ed: Plantarum, 2013.
Sutton, B. C. The Coelomycetes: Fungi Imperfecti with Pycnidia Acervuli and Stromata. 1. ed. Oxford University Press, 1980.
Vitória, N. S. Diversidade de Ascomycota em palmeiras nativas e exóticas em áreas de Mata Atlântica. 225 f. Tese doutorado. Universidade Federal de Pernambuco, Recife, 2012.
Vitória, N. S.; Fortes, N. G. S.; Santos, M. A. L.; Gomes, E. S.; Secunda, E. A.; Cáceres, M. E. S.; Aptroot, A.; Bezerra, J. L. Guia ilustrado de Ascomycota, Raso da Catarina - Bahia. Paulo Afonso: Oxente. 151 p. 2022.
Vitória, N. S.; Santos, M. A. L.; Bezerra, J. L. Contribuições para o conhecimento de fungos (Ascomycotas) em Mauritia flexuosa L.f. e Acrocomia intumescens Drude. Revista Brasileira de Geografia e Física (12) 4.1984-2295 2019.
Vitória, N. S.; Cavalcanti, M. A. Q; Bezerra, J. L. Species of Astrosphaeriella and Fissuroma from palms: new records for South America and Brazil. Nova Hedwigia (1) 2. 0029-5035. 2016.
Vitoria, N. S.; Fortes, N. G. S.; Santos, M. A. L.; Barbosa, R. L. Micota (Ascomycota) de Syagrus coronata (Mart.) Becc., Estação Ecológica Raso da Catarina, Brasil: novos registros. Acta Brasiliensis (4) 2. 2526-4338. 2020.
Vitória, N. S.; Santos, M. A. L; Souza, V. M. F.; Silva, T. B. M; Bezerra, J. L. SEXUAL MORPH OF Stachybotrys frondicola (ASCOMYCOTA): FIRST RECORD IN BRAZIL. ENCICLOPÉDIA BIOSFERA (19) 23. 18677/EnciBio. 2022.
von Arx, J. A.; Figueras, M. J.; Guarro, J. Sordariaceous Ascomycetes Without Ascospore Ejaculation. Nova Hedwigia Beihefte. Germany,1988.
AGRADECIMENTO
À Francisca Maria da Costa pelas coletas e o demonstrativo dos artesanatos na comunidade Sítio Brejinho da Serra. E a Universidade do Estado da Bahia pela estrutura e os laboratórios disponibilizados.
1
Revista Ouricuri, Juazeiro, Bahia, v.14, n.2. 2024, p.03 - 25. Jul./dez., Publicação contínua http://www.revistas.uneb.br/index.php/ouricuri | ISSN 2317-0131